最高のコレクション 半 反応 式 一覧 292879
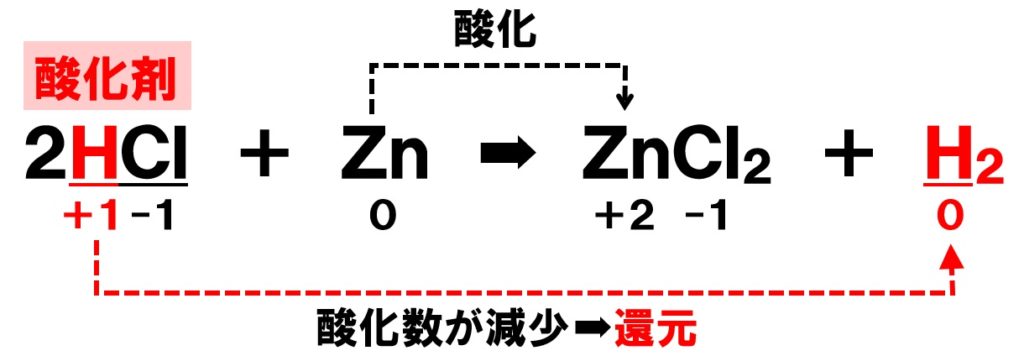
反応して行きます。 ステップ① 亜鉛Znが酸化されて亜鉛イオンZn 2 に なり、電子を投げる! 半反応式は、 Zn→Zn 2 2e – ステップ② 放出された電子は銅線を通って Cuに流れる! ステップ③ 銅は陰イオンにならないので、 溶液中に電子を貰える奴を探す。酸化剤/還元剤の半反応式一覧|4ステップで半反応式は書ける! 酸化剤 Wikipedia;STEP1 : CaCO3 → CaO CO2STEP2 : CaO H2O → Ca(OH)2STEP3 : Ca(OH)2 2NH4Cl → CaCl2 2NH3 2H2OSTEP4 : NaCl H2O NH3 CO2 → NaHCO3 NH4ClSTEP5 : 2NaHCO3 → Na2CO3 H2O CO2 ※アンモニアソーダ法について詳しくは アンモニアソーダ法(覚え方・順番・仕組み・覚え方・反応式など) を参照
酸化還元
半 反応 式 一覧
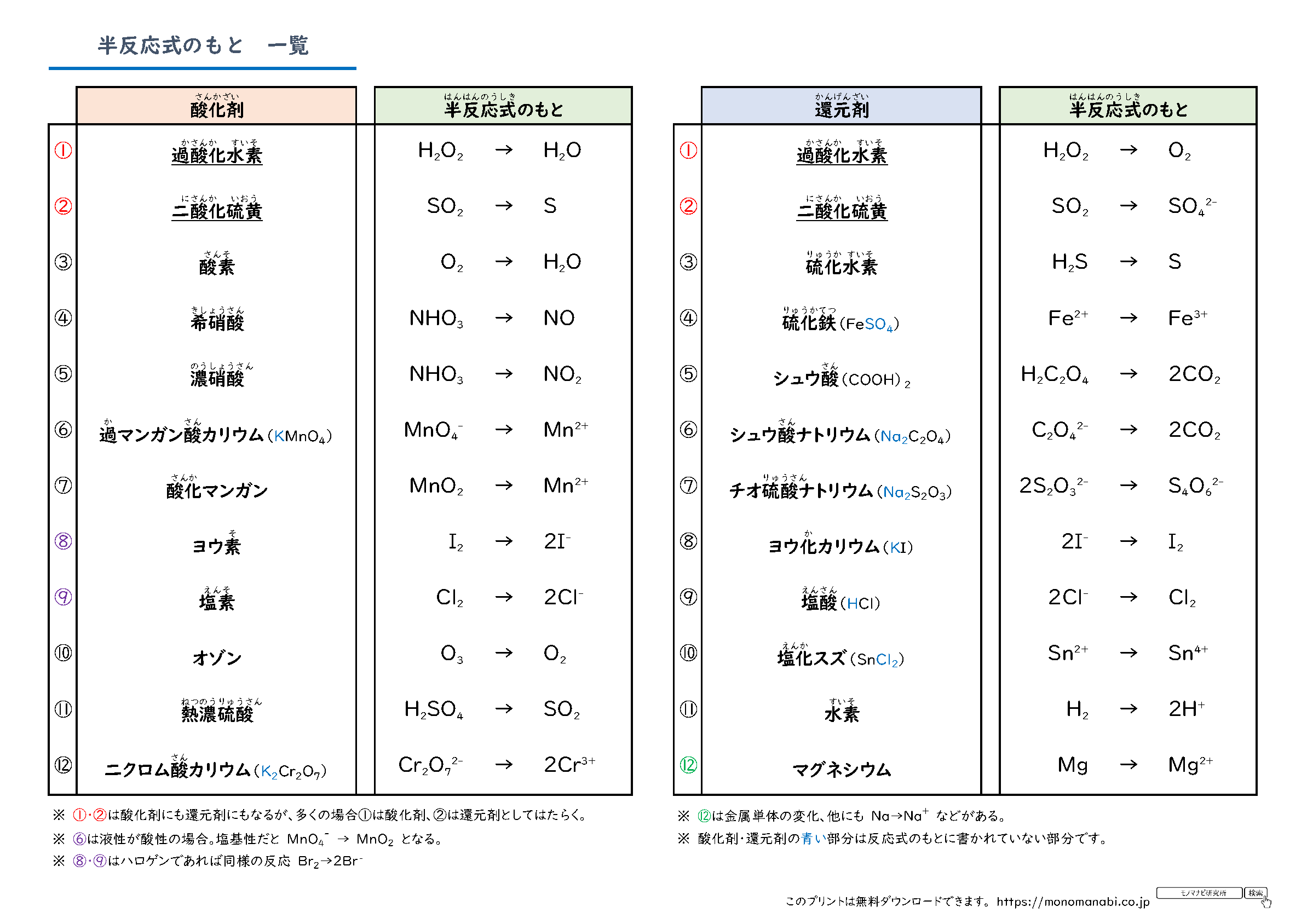
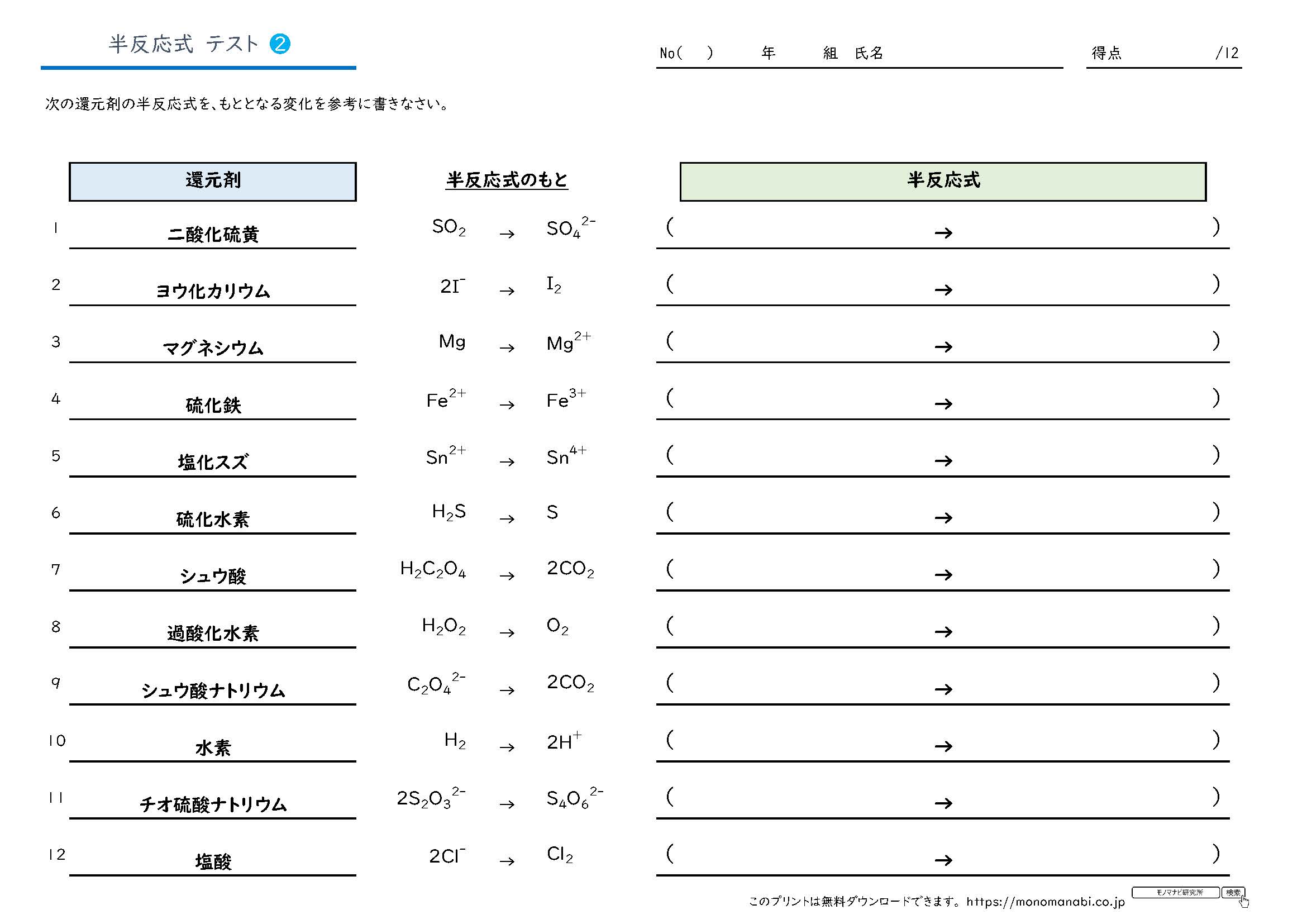
半 反応 式 一覧-半反応式のもとになる一覧とそのテストです。 定期テスト・受験でよく出る半反応式のもとの酸化剤・還元剤を計24種類にまとめました。 この教材は下のAにあたります。 まずはここから頑張ってください。 A~Dの順でクリアできるよう頑張っていきましょう。 A 半反応式のもとを覚える B 半反応式のもと → 半反応式 C 半反応式 → イオン反応式 D イオン反応式 半反応式一覧や、電気分解の表(? 問題の内容も解説も最高 この章で化学反応式を自力で書く力が相当つく 第3章無機物質各論 ここでも無機物質を秀逸な場合分けにより勉強し、最後に元素別に学習する事で無機物質の森を制覇する。 p146から反応の



Http Www Ricen Hokkaido C Ed Jp Action Cabinet Action Main Download Block Id 3760 Room Id 1 Cabinet Id 108 File Id 2942 Upload Id 53
半反応式のもとから半反応式をつくるテストです。 定期テスト・受験でよく出る半反応式のテストです。 テスト ★ 酸化剤(半反応式のもとアリ) テスト ★ 還元剤(半反応式のもとアリ) テスト ★★ 酸半反応式 (はんはんのうしき、 英 half reaction) とは、 酸化還元反応 のうち酸化または還元成分のみを記述した 化学反応式 である。 半反応式は酸化還元反応にかかわるそれぞれの物質の 酸化数 の変化を考えることで得ることができる 。 出典 ^ "HalfReaction 一度半反応式を立てておくと、 意外と生成物は頭に残るものです。 答え合わせができるように、 このページの最後に完全な反応式も記しておきます。 また、まだ半反応式の作り方が不安な場合は、 以下の記事をチェックしておきましょう。
半反応式 下記の ①~④のように物質の電子のやり取りを表した反応式。単独でこの反応が生じ ることはなく、半反応式の組み合わせによって全体の反応が表される。 ①M e→ M ② M 2 2e → M ③ M 3 3e → M ④X 2 +2 e → 2 X 標準還元電位 (標準電極酸化還元反応式の作り方 半反応式を作る 半反応式を作るには酸化剤、還元剤がどうのように変化するかを覚えていなければならない。 代表的な酸化剤、還元剤は前の"酸化剤と還元剤"にのっているので覚えよう。 作り方は大きく分けて二 標準電極電位 標準電極電位の概要 ナビゲーションに移動検索に移動この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。出典を追加して記事の信頼性向上にご協力ください。(13年1月)目次1 理論11 例:酸素還元反
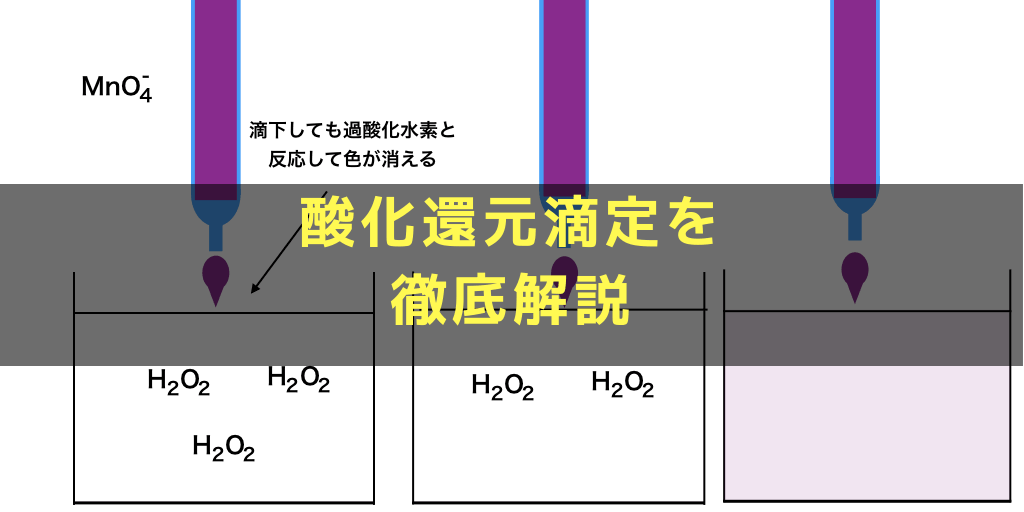
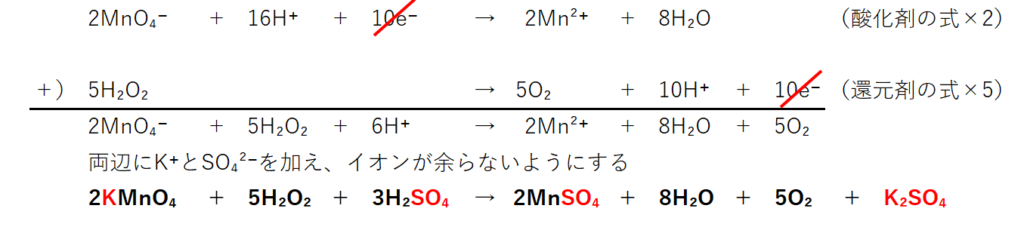
標準電極電位(standard electrode potential)は、ある電気化学反応(電極反応)について、標準状態(反応に関与する全ての化学種の活量が1かつ平衡状態となっている時)の電極電位である。 標準電位(standard potential)、標準還元電位(standard reduction potential)とも呼ばれる。続いて、 電子 に注目しましょう。 H 2 O 2 の半反応式には、右辺に2つのeがあります。 MnO 4の半反応式には、左辺に5つのeがあります。 左辺同士、右辺同士を足し合わせてeを消去したいのですが、eの数が合いませんね。 そこで、H 2 O 2 の半反応式を 5倍 、MnO 4の半反応式を 2倍 してそして, (1) や (2) の半反応式から電子 e - を消去してそれらを組み合わせると,酸化還元反応を示すイオン反応式が得られる。 例えば,塩素 (酸化剤) とヨウ化カリウム (還元剤) の反応は,次式のように



コース 酸化還元反応 半反応式の作り方 呼吸反応




酸化剤と還元剤の半反応式の作り方 極限まで暗記を減らす方法 化学受験テクニック塾
第3回「酸化防止のための抗酸化素材」 食品の酸化防止講座 永久保存版ヘアカラー剤の染料の種類特徴を総まとめ 消火剤の種類 図解でわかる危険物取扱者講座過マンガン酸カリウムの半反応式になぜ水素イオンがでてくるのか?なぜ水が出てくるのか?疑問に答えます。 化学 基礎 酸化還元反応④(3of3)~半反応式~ 化学酸化剤の半反応式④(理系補足1)~ニクロム酸カリと硝酸~ 化学 基礎 酸化還元反応したがって、半反応式①の電子 4eがもつエネルギーは、- 4 ・ F ・ E ① (J) です。 この電子がもつエネルギーを含めて、各物質の標準生成ギブズエネルギーを半反応式の下に記し、半反応の左辺と右辺でエネルギーがバランスする式を解きます。




高校化学基礎 酸化剤の半反応式2 映像授業のtry It トライイット
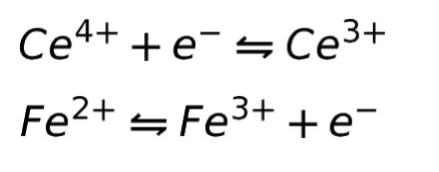



酸化還元電位 薬学 これでok
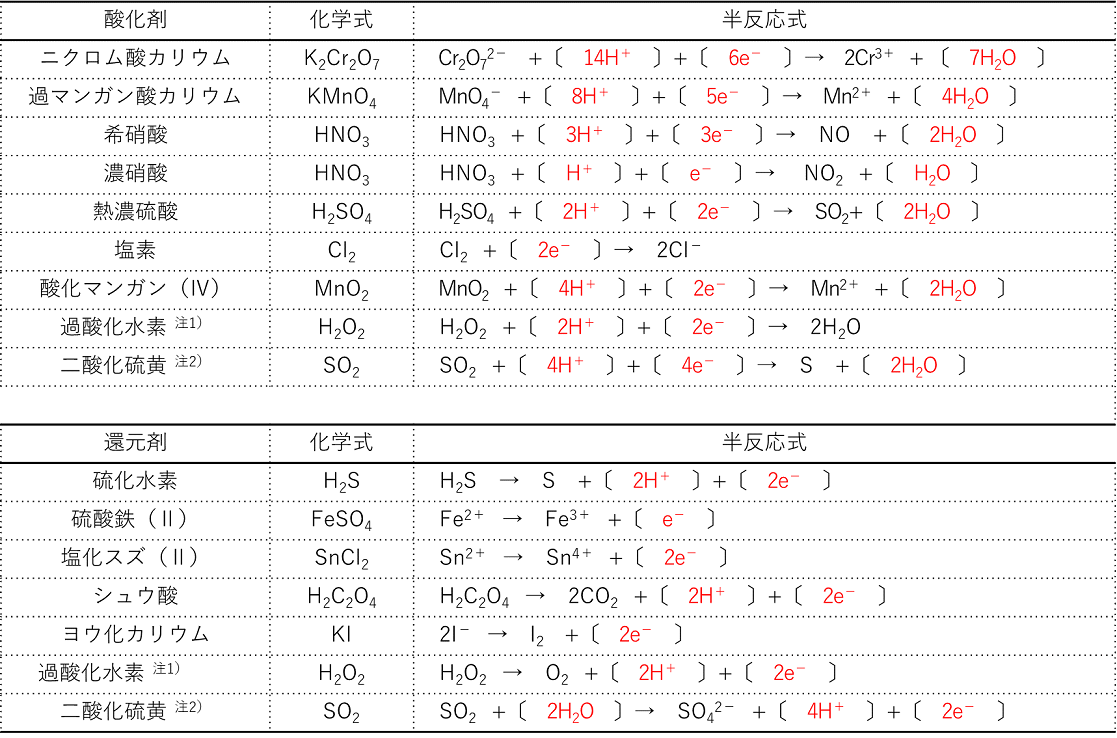
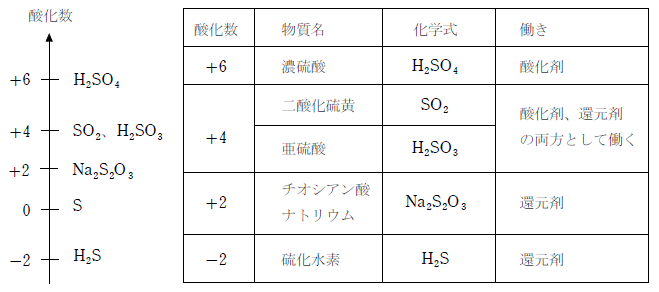
2 酸化還元反応式の作り方(具体例) 塩素と硫化水素が反応したときの酸化還元反応についての化学反応式を書け。 まず、「酸化数とは(求め方・計算問題)」の記事より 硫化水素 は還元剤 であり、反応後は に変化する ので半反応式は次のようになり次には,対象物質の還元を目的に,利用例の多い還元剤とその半反応式を紹介する。なお,還元剤として紹介する過酸化水素と二酸化硫黄は,前述の酸化剤としても作用する。 過酸化水素: h 2 o 2 → o 2 2h 2e 二酸化硫黄: so 2 2h 2 o → so 4 2 4h 2e よう化カリウム: 2ki → なので、半反応式には電子e⁻が登場します。 例えば、次のような式が半反応式になります。 H₂O₂+2H⁺+2e⁻ → O₂+H₂O SO₂+2H₂O → SO₄²⁻+4H⁺+2e⁻ このように、水素イオンH⁺や電子e⁻が登場します。 酸化還元反応では2つの物質が、それぞれ酸化剤・還元剤として働きます。 その片方の物質の変化を表したのが半反応式です。 それぞれの半反応式を



酸化剤と還元剤



中2化学 化学反応式 中学理科 ポイントまとめと整理
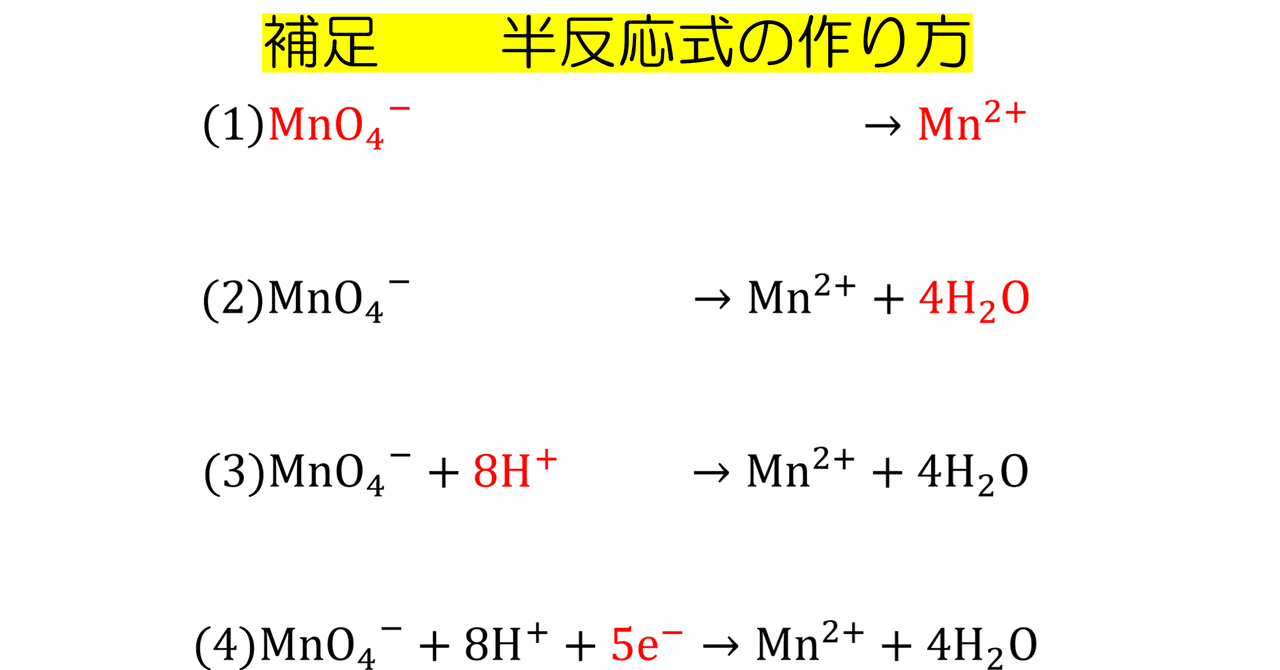
(4)式 で示される反応の寄与を検討した。 2実 験 方 法 溶液内でGlO隔 とC10ゼ が化学的に反応して!;を 生域す る反応の速度を測定するために用いた装置を図1に 示した。次亜 塩素酸ナトリウム溶液(NaC10,半 井化学),または亜塩素酸ナト リウム(NaC1砺,半 井化学 続いて、 還元剤の半反応式の作り方 を説明します。 還元剤である 過酸化水素h 2 o 2 が o 2 に変化する過程の半反応式 を作っていきましょう。 工程は酸化剤のときとあまり変わりません。 1.反応前と反応後の化学式を書く。 この場合は、 h 2 o 2 →o 2 となります。まず、 反応物・生成物を覚えておく 必要があります。 これを覚えていなければ、半反応式を立てることはできません。 今回の場合、反応物は MnO 4、生成物は Mn 2 というものです。 K については、反応の前後で変化しません。 ですから、今回は省略しておきます。



酸化還元




酸化剤 還元剤の半反応式の作り方 Clear
⓪今回は こんにちは!煤色サイエンスです。 今回は酸化剤と還元剤についてです。前回の酸化数や半反応式を用いますので、チェックしてみてください。 ①半反応式 ②酸化剤と還元剤(一覧) ③まとめ ①半還元剤としてのso 2 の半反応式 2 ® s o 2 h o s o 4 h 2 e 2 2 4 しかし, 強い還元力をもつ硫化水素に対しては,酸化剤としてはたらきます。 酸化剤としてのso 2 の半反応式 ®式()は還元の半反応を、式()は酸化の半反応を表して いる。還元反応(式())は⊿G r、つまり、その反応のギブスの自由エネルギーを計算する ことによってもまた記述されることができる。 ⊿G r = ⊿G r0 RTln(Red) / (Ox)( H)m (85)
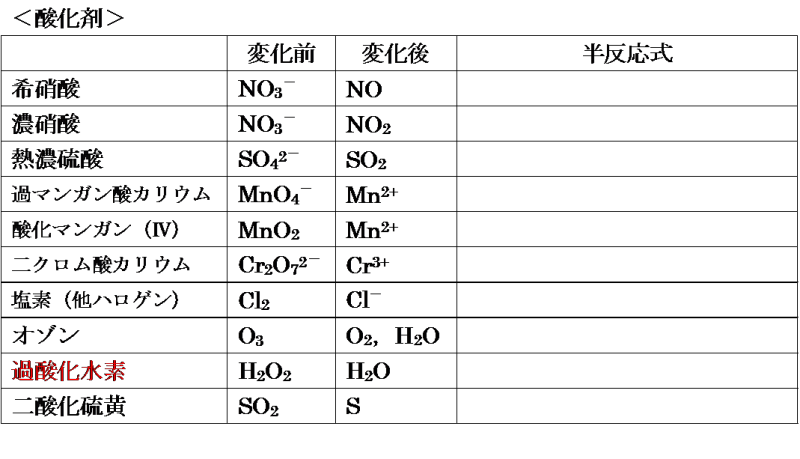



酸化還元反応の半反応式 化学がちょっとだけ好きな社労士




高校化学基礎 酸化剤の半反応式1 映像授業のtry It トライイット
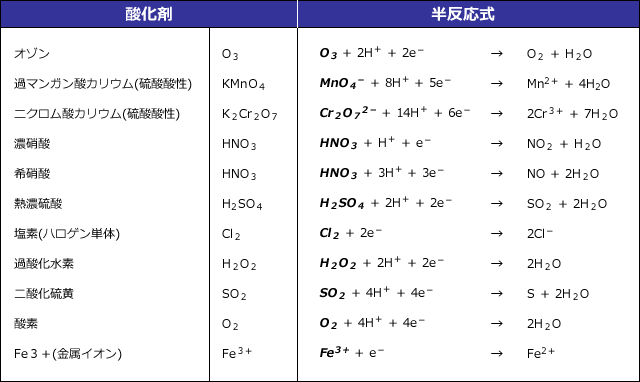
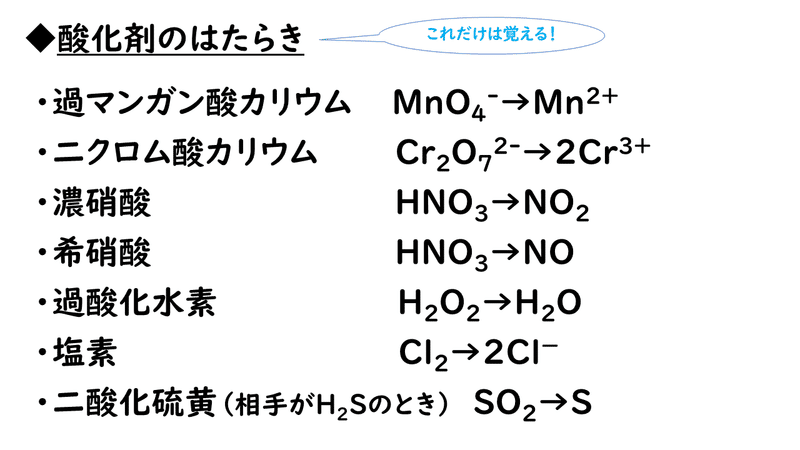
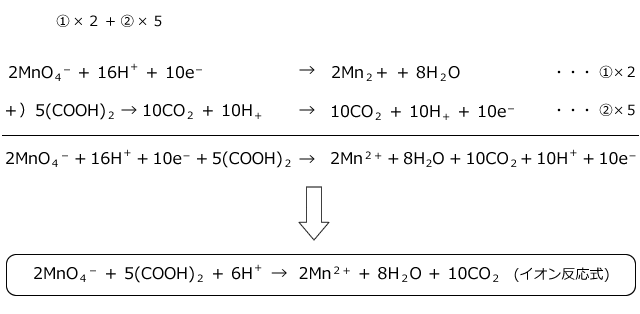
そして, (1) や (2) の半反応式から電子 e - を消去してそれらを組み合わせると,酸化還元反応を示すイオン反応式が得られる。 例えば,塩素 (酸化剤) とヨウ化カリウム (還元剤) の反応は,次式のように酸素 o 2 → h 2 o オゾン o 3 → o 2 塩素 cl 2 → cl – フッ素 f 2 → f – ヨウ素 i 2 → i – 濃硝酸 hno 3 → no 2 希硝酸 hno 3 → no 熱濃硫酸 h 2 so 4 → so 2 二クロム酸カリウム cr 2 o 7 2→ cr 3 過マンガン酸カリウム mno 4 – → mn 2 酸化マンガン mno 2 → mn 2 さらし粉・次亜塩素酸ナトリウム clo – → cl –半反応式 半反応式とは、酸化還元反応で使用される化学反応式のことです。 電子 ( e) を含んでいることが特徴 です。 例えば、過マンガン酸カリウムの水溶液中での反応は、 MnO4+8H+5e→Mn2+4H2O と表されます。 ここでは、よく登場する酸化剤・還元剤を挙げておきましょう。 酸



酸化還元滴定とは 問題の解法とゼロからわかる半反応式の作り方



半反応式 一覧
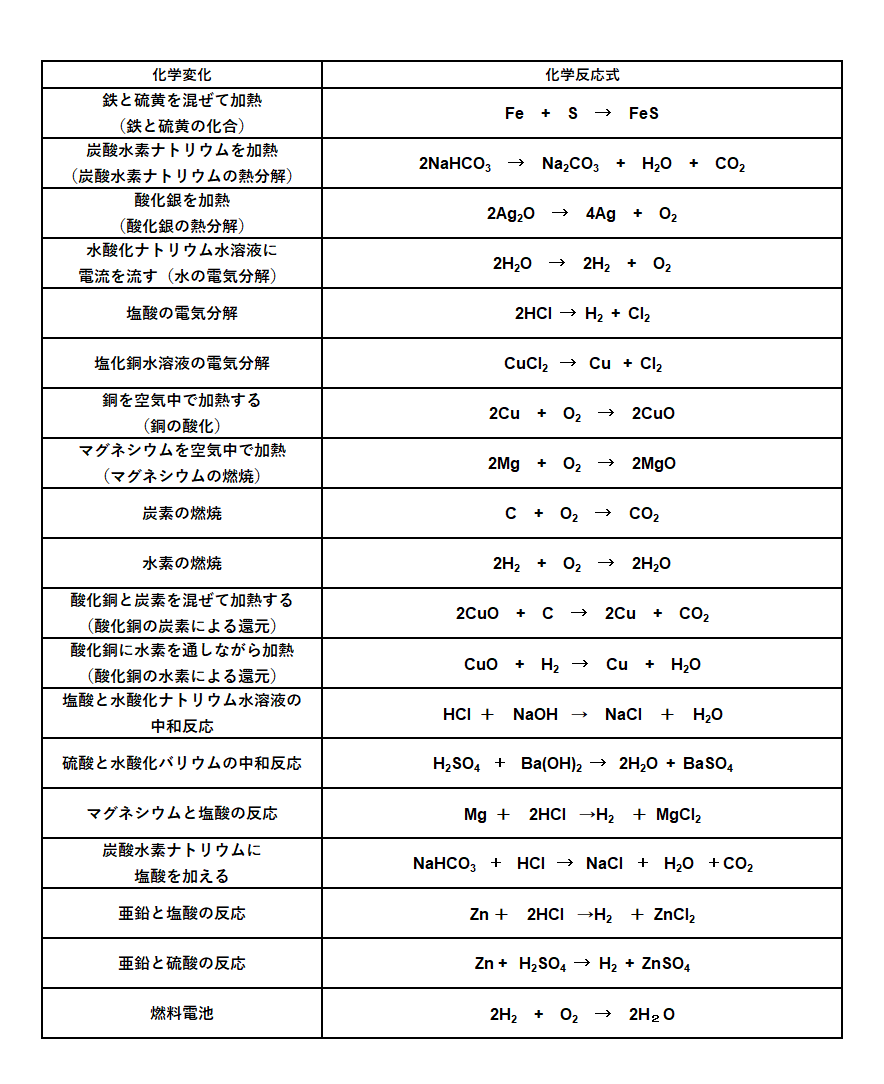
電池を作成したときに、二つの電極における各電極反応に伴う電位差から、 電池の電位差(起電力)を求めることができる。水素ガス、酸素ガスを用いた 水素酸素燃料電池(電極はpt 電極を用いる)を考えてみよう。 h21/2o2 Æh2o e 0=?1.酸化・還元の半反応式を組み合わせる。 2.h がある場合は,酸の陰イオンを組み合わせる。 cu , h2so4(熱濃硫酸)→so2 cu , hno3(希硝酸)→no cu , hno3 (濃硝酸)→no2 金属が溶けて,h2 以外の気体(so 2,no,no )を発生する場合 反応式の作り方2主な化学反応式一覧・暗記帳 ※化学反応式は「隠す」ボタンを押すと隠れます( マウスカーソルをのせる と表示されます)。 「表示する」ボタンを押すと再び表示されます。 ※「ランダムに並べ替え」ボタンを押すと化学反応式をランダムに並べ替えます。 「 」「 」を押すと各項目の順番に並べ替えます。 「元の順番に戻す」ボタンを押すと元の順番に戻り




半反応式って何を覚えたらいいんですか Clear




希硝酸の半反応式の作り方 化学のグルメ



Http Www Ricen Hokkaido C Ed Jp Action Cabinet Action Main Download Block Id 3760 Room Id 1 Cabinet Id 108 File Id 2942 Upload Id 53



コース 酸化還元反応 半反応式の作り方 呼吸反応




高校化学基礎 酸化還元反応式のつくり方 映像授業のtry It トライイット




酸化還元反応式の作り方 理系ラボ



Www1 Doshisha Ac Jp Bukka Lecture General Resume G Gc 13 12 Pdf




ひでと Quimica化学講師 A Twitter 化学基礎 9 酸化還元反応 まで対応 酸化数 で酸化数の付け方 半反応式 で酸化剤 還元剤の一覧 イオン化列 で一覧と暗記法が出るようになってます




過酸化水素水の半反応式は 2個あります ほかの半反応式を用いて酸化 高校 教えて Goo



過 マンガン 酸 カリウム シュウ 酸 ナトリウム 反応 式




高校理論化学 ヨウ素酸化滴定 ヨージメトリー 受験の月




酸化剤 還元剤の半反応式の作り方 Clear




高校化学のつぶやき
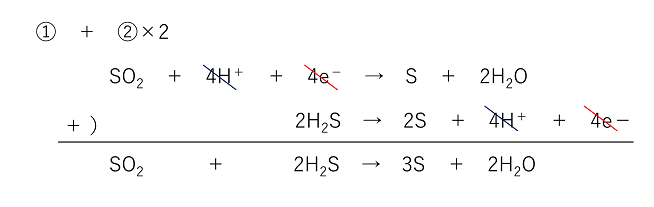



酸化剤と還元剤
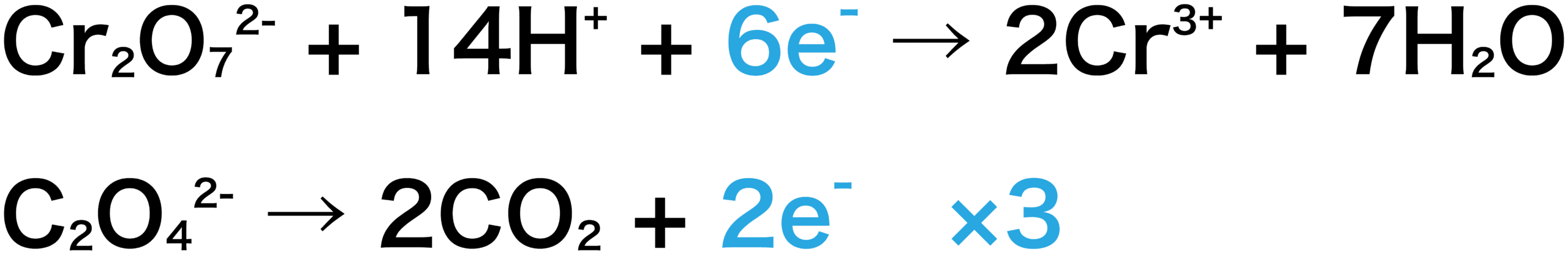



半反応式 酸化還元反応式 作り方 覚え方 問題演習など 化学のグルメ



高校化学基礎 半反応式 についてです どうしてhno Yahoo 知恵袋




授業実践記録 化学 酸化還元反応の身の回りへの応用 亜鉛めっき をとおして 啓林館




書けて欲しい半反応式 3 化学がちょっとだけ好きな社労士



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス




酸化剤 還元剤の半反応式一覧 4ステップで半反応式は書ける



Q Tbn And9gcrf2igb3kreq8w0u7euxpyagwgwmnanul kmlbfka18ebnvpl Usqp Cau




半反応式の作り方 Chemihack おうちで学べる化学



Http Bunshi4 Bio Nagoya U Ac Jp Bunshi4 Class 16kisoseika 0627 Pdf



コース 酸化還元反応 半反応式の作り方 呼吸反応




高校無機化学 酸化数の決め方 酸化還元反応 酸化剤と還元剤 受験の月




二 クロム 酸 カリウム 半 反応 式 化学講座 第21回 酸化と還元 酸化剤と還元剤 酸化還元反応式 Docstest Mcna Net



化学講座 第21回 酸化と還元 酸化剤と還元剤 酸化還元反応式 私立 国公立大学医学部に入ろう ドットコム



二クロム酸カリウムの半反応式 この画像の上か下の式 どちらか Yahoo 知恵袋




高校化学 電気分解の各極のイオン反応式の作り方やルールを徹底解説 フローチャート通りにやれば簡単に作れる 化学の偏差値が10アップするブログ



モノマナビ研究所




高校化学基礎 過酸化水素vs過マンガン酸カリウム 映像授業のtry It トライイット




酸化還元反応 電子のやり取り



47 イオン反応式 みかみ 一桜




半反応式の右側がイオンの形になるものとならないものの違いってなんですか Clear



化学基礎 覚えるべき酸化剤と還元剤 Tekibo



Q Tbn And9gcrisyson6ohjlj9p T8h Z5rty8ze4mp3bqrs4t6imikrr6or9p Usqp Cau



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス




半反応式の作り方 9 Fes Hcl H2s Nh4cl Naoh Nh3 Caf2 H2so4 Hf Na2co3 Hcl Co2 Nahco3 Hcl Co2 Na2so3 Hcl So2



無機化学 第回 硫黄 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム



高校化学 酸化還元反応を極めろ 半反応式の書き方と一覧 はらこのブログ




高校化学が苦手な受験生必見 化学反応式の覚え方のコツをご紹介 予備校いくなら逆転合格の武田塾



7 3 酸化剤と還元剤 おのれー Note




酸化還元反応の 一見複雑な 反応式 化学がちょっとだけ好きな社労士



半反応式 暗記



酸化と還元の基礎 水浄化フォーラム 科学と技術



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Half Reaction Formular Water




30 化学基礎 酸化剤還元 半反応式の書き方 Youtube




2と4の考え方が分かりません Clear




酸化還元反応 電子のやり取り
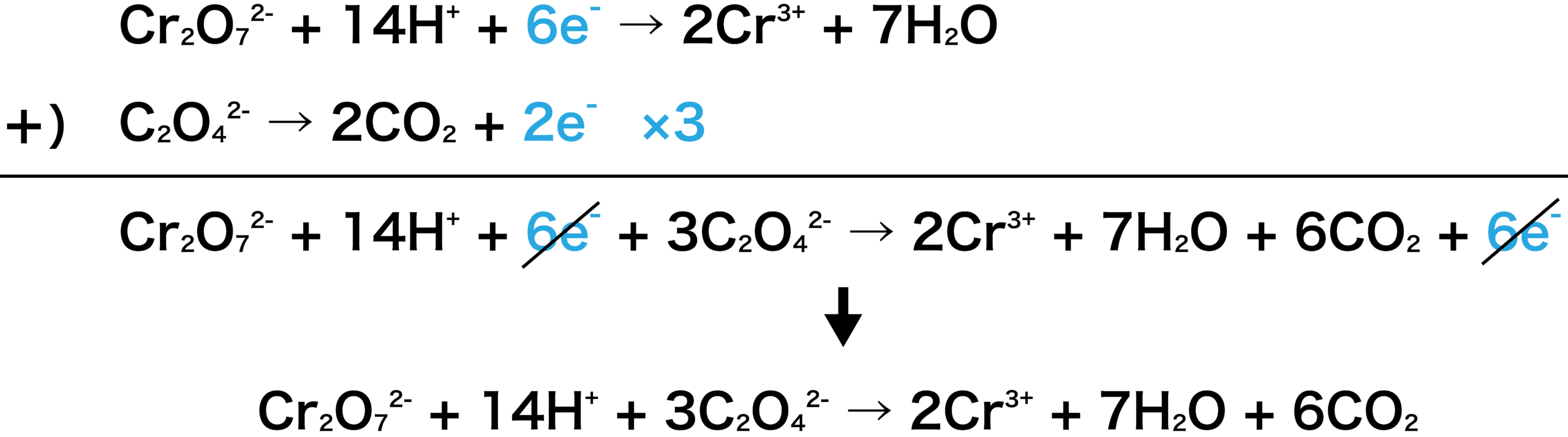



半反応式 酸化還元反応式 作り方 覚え方 問題演習など 化学のグルメ



酸化剤と還元剤 化学基礎 高校化学net参考書




補助教材02 半反応式を使って塩素の発生の反応式を書いてみる Youtube




半反応式から化学反応式を導く方法は2ステップでok




半反応式の意味 用法を知る Astamuse



48 半反応式 2 みかみ 一桜



酸化還元




7 3 酸化剤と還元剤 おのれー Note



酸化還元反応 電子のやり取り




半反応式の作り方を解説 酸化剤 還元剤の見分け方と一覧表も 高校生向け受験応援メディア 受験のミカタ




化学講座 第21回 酸化と還元 酸化剤と還元剤 酸化還元反応式 私立 国公立大学医学部に入ろう ドットコム




半反応式 Wikipedia



化学講座 第21回 酸化と還元 酸化剤と還元剤 酸化還元反応式 私立 国公立大学医学部に入ろう ドットコム



高校無機化学 補足 半反応式の作り方 りふれくとん Note



主な化学反応式一覧 中学理科で登場する化学反応式のまとめ 教科書をわかりやすく通訳するサイト




高校化学 酸化還元 半反応式から化学反応式を作る オンライン無料塾 ターンナップ Youtube



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス



半反応式を教えてください 酸化数なども お願いします Yahoo 知恵袋



シュウ 酸 還元 剤 酸化還元反応式 計算問題の解法 Amp Petmd Com




半反応式か化学反応式か 鉛蓄電池の典型問題 化学がちょっとだけ好きな社労士




チオ硫酸ナトリウム 還元剤 化学がちょっとだけ好きな社労士



化学基礎 半反応式のつくり方




化学式 と 化学 反応 式 の 違い モル計算で受験生が勘違いしている事 反応式は作るな Amp Petmd Com



酸化と還元の基礎 水浄化フォーラム 科学と技術




半反応式について質問です 例えば硫酸鉄だったら Fe 2 Fe 3 Clear




半反応式 Okedic




酸化還元反応 電子を含むイオン反応式 化学基礎 定期テスト対策サイト



Q Tbn And9gcsitmsrstnmxzavmcn Eg5bfzwe9j3zozdn Frhherwf5a9epq0 Usqp Cau




化学式 と 化学 反応 式 の 違い モル計算で受験生が勘違いしている事 反応式は作るな Amp Petmd Com



2
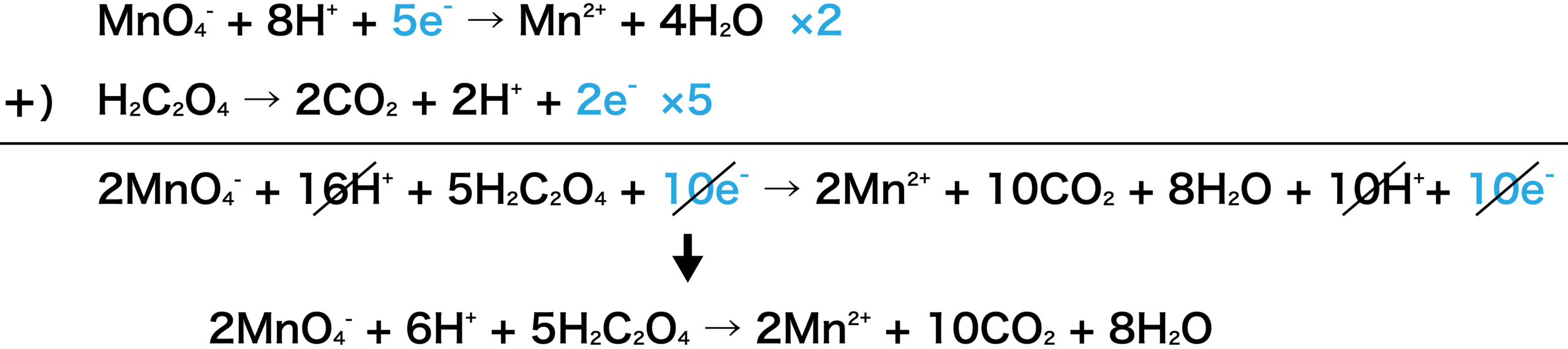



半反応式 一覧 覚え方




学習履歴 3 15 金 17 日 マイ シルクロード




高校化学基礎 主な酸化剤 還元剤 映像授業のtry It トライイット




酸化反応の教科書 基礎 反応例まで7つのポイント 化学のススメ



Http Theochem Chem Okayama U Ac Jp Vitroid E6 95 99 E9 8a E7 E7 90 86 E5 8c 96 E5 Ad A612 13 02 01note14 Pdf




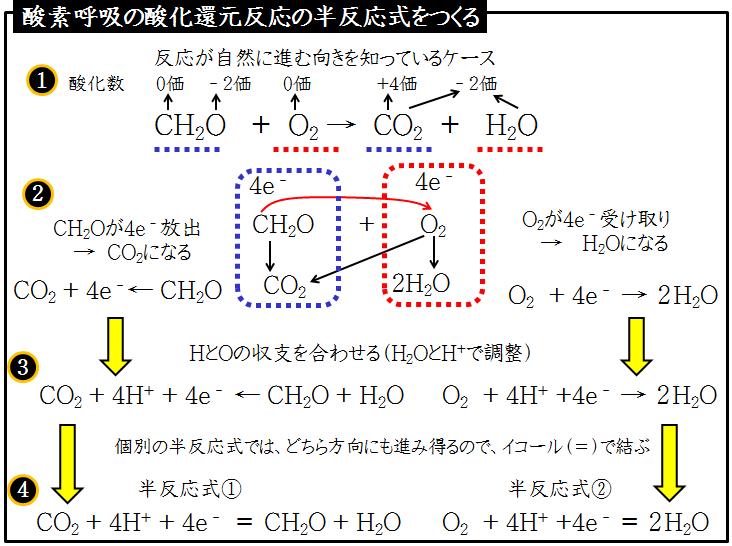
ホルムアルデヒドの酸化還元反応の半反応式 化学がちょっとだけ好きな社労士



受験基礎化学 26 酸化還元反応 みかみの参考書ブログ




半反応式一覧 化学のグルメ



塾長の備忘録 化学 酸化還元反応



コース 呼吸反応の半反応式



Search Q E5 8c 96 E5 Be E5 90 91 Tbm Isch



無機化学 第19回 酸素 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム
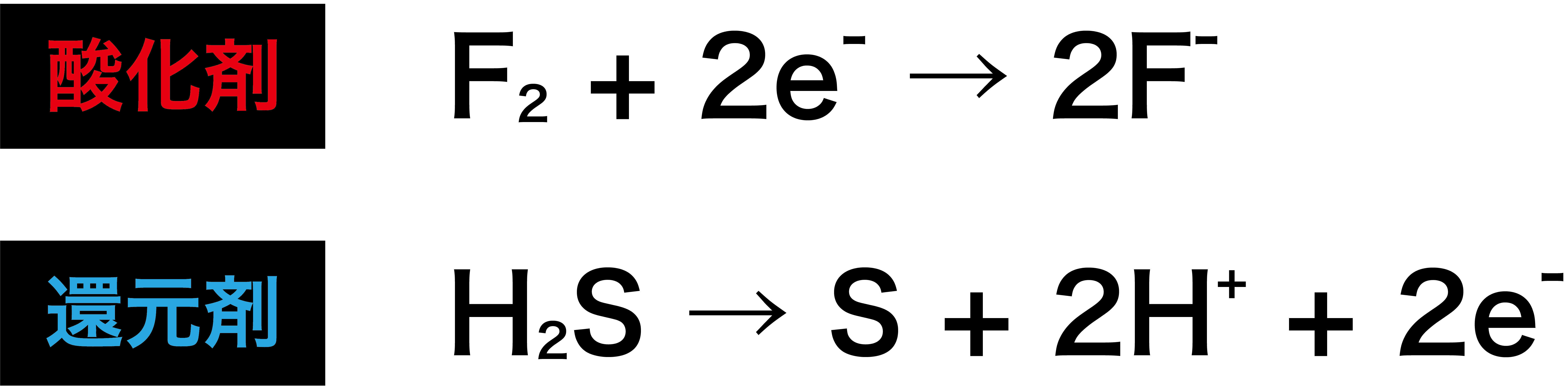



半反応式 酸化還元反応式 作り方 覚え方 問題演習など 化学のグルメ


コメント
コメントを投稿